今回は、「混合気体の圧力」についての話題です。。。
ポイント
- ボイルの法則:$P_1V_1 = P_2V_2 ~~~~(温度一定)$
- シャルルの法則:$\dfrac{V_1}{T_1}=\dfrac{V_2}{T_2}~~~~~(圧力一定)$
- ボイル・シャルルの法則: $\dfrac{P_1V_1}{T_1}=\dfrac{P_2V_2}{T_2}$
- 気体の状態方程式: $PV=nRT$
- 混合気体の分圧は、それぞれの気体が容器全体を占めているときの圧力に相当する。
ということがポイントになります。
では、さっそく、考えてみましょう。
問題
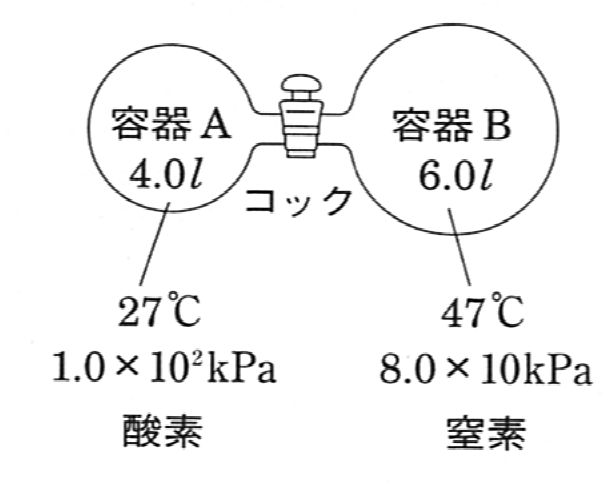
図のようなコックで連結された容器A (4.0 $\ell$) と容器B (6.0 $\ell$) がある。 容器 A には 27℃、$1.0\times10^2 $kPa の酸素を、容器B には 47℃、$8.0\times10$kPa の窒素を詰めた。 次の各問いに答えよ。

図のようなコックで連結された容器A (4.0 $\ell$) と容器B (6.0 $\ell$) がある。 容器 A には 27℃、$1.0\times10^2 $kPa の酸素を、容器B には 47℃、$8.0\times10$kPa の窒素を詰めた。 次の各問いに答えよ。
- コックを開き、容器全体を 87 ℃ に保った。容器内の混合気体の全圧は何kPa になるか。
- この混合気体の平均分子量を求めよ。
- コックを開くと、O$_2$ は容器全体に広がる(拡散)から、その体積は、
$$4.0 + 6.0 = 10.0~~(~\ell~)$$
になる。
混合後の O$_2$ の分圧を $p_{O_{2}}$ とおくと、「ボイル・シャルルの法則」より、 $$\frac{1.0\times10^2\times 4.0}{300} = \frac{p_{O_2} \times 10.0}{360}$$ $$\therefore p_{O_2} = 4.8\times10~~[~\mathrm{kPa}~]$$ 同様に、混合後のN$_2$の分圧を $p_{N_2}$ とおくと、 $$\frac{8.0\times10\times6.0}{320} = \frac{p_{N_2}\times 10.0}{360}$$ $$\therefore p_{N_2}=5.4\times10~[~\mathrm{kPa}~]$$ よって、 $$全圧 = p_{O_2}+p_{N_2}=(4.8\times10)+(5.4\times10)$$ $$\therefore 全圧 = 10.2\times 10 \approx 1.0\times10^2~[~\mathrm{kPa}~] //$$ - 平均分子量とは、混合気体がただ1種類の気体だけからなるとみなして求められた見かけの
分子量のことである。
混合気体では、体積一定では、 $$分圧の比 ~=~ 物質量の比$$ が成り立つので、物質量の比は、 $$\mathrm{O}_2 : \mathrm{N}_2 = 4.8\times 10 : 5.4\times 10=8 : 9$$ ここで、分子量は、O$_2$=32、N$_2$=28 なので、混合気体1molの質量は、 $$32[\mathrm{g/mol}]\times\frac{8}{8+9}+28[\mathrm{g/mol}]\times\frac{9}{8+9}$$ $$= 29.882\cdots \approx 30~[~\mathrm{g/mol}~] //$$
問題
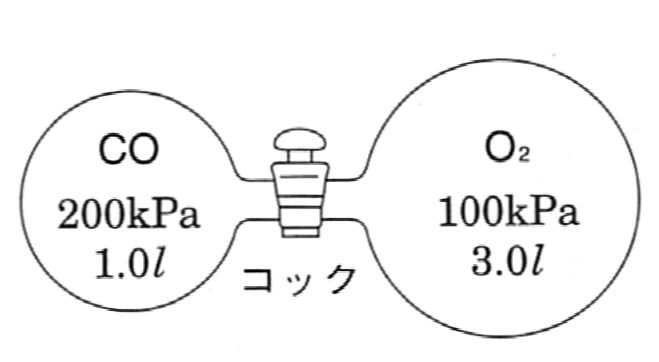
図の装置に一酸化炭素と酸素を別々に封入し、温度を 27 ℃に保った。

図の装置に一酸化炭素と酸素を別々に封入し、温度を 27 ℃に保った。
- コックを開いて両気体が均一になったとき、各気体の分圧を求めよ。
- コックを開いたまま、電気火花によって一酸化炭素を完全に燃焼させた後、温度をもとへ戻すと、 容器内の圧力は何kPaを示すか。
- CO、O$_2$ の分圧をそれぞれ $p_{CO}$、$p_{O_2}$ とすると、 $$200\times1.0=p_{CO}\times4.0$$ $$\therefore p_{CO} = 50~[~\mathrm{kPa}~] //$$ $$100\times3.0=p_{O_2}\times4.0$$ $$\therefore p_{O_2} = 75~[~\mathrm{kPa}~] //$$
- 温度、体積が一定なので、
$$分圧比 ~=~ 物質量の比$$
が成り立つ。
$~~~~~~~~~~~~~~~~~~~~~~2\mathrm{CO}~~~~~ +~~~~~ \mathrm{O}_2~~~~~ \longrightarrow 2 \mathrm{CO}_2$
$反応前:~~~~50~\mathrm{kPa}~~~~~~~~~~ 75~\mathrm{kPa}~~~~~~~~~~~~ 0$
$反応後:~~~~0~\mathrm{kPa}~~~~~~~~~~ 50~\mathrm{kPa}~~~~~~~~~~ 50~\mathrm{kPa}$
以上より、 $$\therefore 全圧~=~50+50=100~[~\mathrm{kPa}~] //$$
いかがでしたか。
理解は出来ましたか?
では、また次回にお会いしましょう。